一氧化氮和氧气反应是可逆反应吗
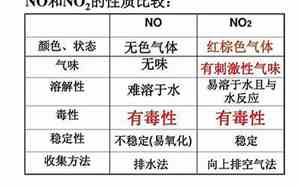
一氧化氮与氧气(O2)的反应是一个基本的氧化还原反应,通常在无催化剂条件下进行。这个过程称为一氧化氮的氧化,生成的是二氧化氮(NO2)。反应方程式如下:
```markdown
2NO + O2 → 2NO2
在这个反应中,一氧化氮是还原剂,因为它失去了氧,而氧气是氧化剂,因为它夺取了氮氧化物的氧。NO2的形成是一个典型的放热反应,释放出能量。这个反应在许多环境和工业过程中都有重要应用,比如在汽车尾气处理中,一氧化氮与氧气反应生成NO2,再进一步转化为更无害的气体如氮气(N2)和水蒸气(H2O),通过催化转化器实现。请注意,NO2本身也是一种空气污染物,对环境和健康有潜在危害。
一氧化氮和氧气反应生成什么
一氧化氮与氧气(O2)反应生成二氧化氮(NO2)。这是一个典型的化学反应,反应方程式为:
\[ 2NO + O_2 → 2NO_2 \]
在这个过程中,一氧化氮分子接受氧气分子的一个氧原子,从而氧化成二氧化氮。这个氧化反应常在高温或燃烧条件下发生,例如在内燃机的燃烧室或者特定的化学实验中。生成的二氧化氮是一种有毒气体,对环境和健康都有影响。在实际应用中,如汽车尾气处理,会利用这种反应来减少NO和NO2的排放。
一氧化氮和氧气反应是可逆反应吗
一氧化氮和氧气(O2)反应生成二氧化氮(NO2)的反应,虽然在特定条件下可以进行,但它通常不是严格意义上的可逆反应。可逆反应是指两个反应方向都能进行,且在条件改变时可以相互转化,左右两个反应速率相等。NO与O2生成NO2的反应是一个单向反应,即NO在接触到O2时主要转化为NO2,除非有额外的还原剂参与,才有可能逆转回NO。
在实际情况下,由于反应的产物NO2通常不会自发地分解成NO和O2,因此这个过程是不可逆的,除非在实验室条件下通过特殊的实验手段来实现。在自然界或者工业应用中,这些反应往往是单向进行的,除非有特别设计的条件来促进反向过程。
一氧化氮和氧气反应方程式
一氧化氮与氧气(O2)反应生成二氧化氮(NO2),反应方程式为:
\[ 2NO + O_2 \rightarrow 2NO_2 \]
这个化学方程式表示,当两个一氧化氮分子与一个氧分子结合时,会生成两个二氧化氮分子。这个反应是一个氧化反应,因为NO在接受氧原子时被氧化。在实际环境中,这种反应通常发生在发动机燃烧、工业合成或者特定的实验室条件下。
氧气与一氧化氮反应可逆吗
氧气与一氧化氮反应生成二氧化氮(NO2)的反应,方程式为:
\[ 2NO + O_2 \rightarrow 2NO_2 \]
这个反应是不可逆的。也就是说,生成的二氧化氮(NO2)通常不会自发地分解成一氧化氮和氧气(O2)。在自然环境和许多工业过程中,由于NO2的稳定性,这个反应是单向进行的。如果需要将NO2转化为NO和O2,通常需要外部条件(如催化剂)和特定的反应条件才能实现,这并不是一个自发的可逆过程。在实际应用中,如汽车尾气处理,通过添加催化剂来促使NO2的部分转化回NO和O2,但这并不代表整个反应是一个可逆过程。


