乙醇燃烧的化学方程式和现象
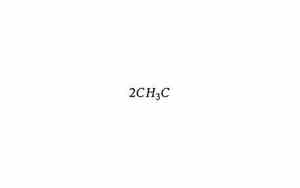
乙醇(C2H5OH)燃烧的化学方程式是:
C2H5OH + 3O2 → 2CO2 + 3H2O
在这个反应中,乙醇和氧气反应生成二氧化碳和水。乙醇分子中的碳、氢和氧原子通过氧化反应被释放出来。
甲烷(CH4)燃烧的化学方程式是:
CH4 + 2O2 → CO2 + 2H2O
甲烷在充足的氧气中燃烧,生成二氧化碳和水蒸气。甲烷的燃烧是天然气的主要成分用于燃烧的重要反应,因为它释放出大量的能量,但燃烧产物对环境相对较为友好,因为二氧化碳是植物光合作用的原料。
这些反应都是在点燃的条件下进行的,且通常伴随着热量释放。在实际应用中,比如在汽车引擎或家庭炉灶中,燃料的燃烧是能量转换的关键过程。
乙醇燃烧是什么反应类型
乙醇(C2H5OH)燃烧的反应类型属于氧化反应,具体来说是氧化燃烧反应。在燃烧过程中,乙醇分子与氧气(O2)发生反应,生成二氧化碳(CO2)和水(H2O),同时释放出大量的热能。这种化学反应是放热的,通常是剧烈的,可以发光发热,并且满足氧化还原反应的基本特征,即乙醇中的碳和氢被氧化,而氧被还原。这种类型的反应在日常生活中常见,如酒精灯、汽车引擎和家用炉灶等。
乙醇催化氧化的方程式
乙醇的催化氧化,特别是生成乙醛(CH3CHO)的反应,常用作工业过程中的一个步骤,比如在酿酒行业或者制醋过程中。在铜或银催化剂的催化下,乙醇与氧气(O2)反应,生成乙醛和水(H2O),反应方程式如下:
2C2H5OH + O2 → 2CH3CHO + 2H2O
在催化剂(如铜或银)存在时,这个反应不需要很高的温度,反应速率比简单燃烧要慢得多。催化氧化反应常用于工业有机合成中,因为它可以控制反应的产物,得到特定的化合物。但请注意,这个反应通常在实验室条件下进行,实际工业生产中,可能使用不同的催化剂和条件。
乙醇点燃反应方程式
乙醇(C2H5OH)在点燃的条件下与氧气(O2)反应生成二氧化碳(CO2)和水(H2O),这是一个典型的燃烧反应。反应方程式如下:
C2H5OH + 3O2 → 2CO2 + 3H2O
这个过程中,乙醇分子中的碳、氢和氧原子与氧气分子结合,生成了二氧化碳和水,同时释放出大量的热和光(火焰)。这是一个放热反应,是许多化学实验和日常生活中常见的一种氧化反应。例如,酒精灯、汽车发动机、燃料电池等都是这种反应的实际应用。
初中化学方程式大全总结
初中化学方程式大全相当广泛,涵盖了多个基础的化学反应。以下列举了一些常见的初中化学反应方程式,以供参考:
1. 水的电解:
2H2O → 2H2 + O2
2. 铁和硫酸反应(置换反应):
Fe + H2SO4 → FeSO4 + H2
3. 木炭燃烧:
C + O2 → CO2
4. 过氧化氢分解(实验室制氧气):
2H2O2 → 2H2O + O2
5. 氢气燃烧:
2H2 + O2 → 2H2O
6. 甲烷燃烧:
CH4 + 2O2 → CO2 + 2H2O
7. 酒精燃烧(乙醇):
C2H5OH + 3O2 → 2CO2 + 3H2O
8. 碳酸氢钠和盐酸反应(中和反应):
NaHCO3 + HCl → NaCl + H2O + CO2
9. 铁锈(Fe2O3)和盐酸反应:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
10. 二氧化碳气体溶解于水生成碳酸:
CO2 + H2O → H2CO3
请注意,这只是一个简要的列表,实际化学方程式中可能还涉及到更多复杂的化合物和反应条件。初中阶段的化学方程式通常侧重于基本的反应类型,如氧化、还原、酸碱反应、分解和合成等。对于更全面的建议参考教材或在线资源。


